- Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil.
- ikatan hidrogen adalah Ikatan ini merupakan gaya tarik menarik antara atom H dengan atom lain yang mempunyai keelektronegatifan besar pada satu molekul dari senyawa yang sama.
- ikatan van der walls adalah Gas mempunyal sifat bentuk dan volumenya dapat berubah sesuai tempatnya. Jarak antara molekul-molekul gas relatif jauh dan gaya tarik menariknya sangat lemah. Pada penurunan suhu, fasa gas dapat berubah menjadi fasa cair atau padat. Pada keadaan ini jarak antara molekul-molekulnya menjadi lebih dekat dan gaya tarik menariknya relatif lebih kuat. Gaya tarik menarik antara molekul-molekul yang berdekatan ini disebut gaya Van der walls.
berikut ini, akan saya jelaskan mengenai ikatan logam :
Apakah ikatan logam itu?
Adalah ikatan yang terbentuk akibat adanya gaya tarik-menarik yang terjadi antara muatan positif dari ion-ion logam dengan muatan negatif dari elektron-elektron yang bebas bergerak.
Atom-atom logam dapat diibaratkan seperti bola pingpong yang terjejal rapat 1 sama lain.Atom logam mempunyai sedikit elektron valensi, sehingga sangat mudah untuk dilepaskan dan membentuk ion positif. Maka dari itu kulit terluar atom logam relatif longgar (terdapat banyak tempat kosong) sehingga elektron dapat berpindah dari 1 atom ke atom lain.Mobilitas elektron dalam logam sedemikian bebas, sehingga elektron valensi logam mengalami delokalisasi yaitu suatu keadaan dimana elektron valensi tersebut tidak tetap posisinya pada 1 atom, tetapi senantiasa berpindah-pindah dari 1 atom ke atom lain.

Elektron-elektron valensi tersebut berbaur membentuk awan elektron yang menyelimuti ion-ion positif logam.
Struktur logam seperti gambar di atas, dapat menjelaskan sifat-sifat khas logam yaitu :
a). berupa zat padat pada suhu kamar, akibat adanya gaya tarik-menarik yang cukup kuat antara elektron valensi (dalam awan elektron) dengan ion positif logam.
b). dapat ditempa (tidak rapuh), dapat dibengkokkan dan dapat direntangkan menjadi kawat. Hal ini akibat kuatnya ikatan logam sehingga atom-atom logam hanya bergeser sedangkan ikatannya tidak terputus.
c). penghantar / konduktor listrik yang baik, akibat adanya elektron valensi yang dapat bergerak bebas dan berpindah-pindah. Hal ini terjadi karena sebenarnya aliran listrik merupakan aliran elektron.
lalu... apa contohnya???
Ikatan logam pada natrium
Logam cenderung memiliki titik leleh dan titik didih yang tinggi sehingga memberikan kesan kuatnya ikatan yang terjadi antara atom-atomnya. Secara rata-rata logam seperti natrium (titik leleh 97.8°C) meleleh pada suhu yang sangat jauh lebih tinggi dibanding unsur (neon) yang mendahuluinya pada tabel periodik.
SNatrium memiliki struktur elektronik 1s22s22p63s1. Ketika atom-atom natrium datang secara bersamaan, elektron pada orbital atom 2s dari satu atom natrium membagi ruang dengan elektron yang bersesuaian pada atom tetangganya untuk membentuk sebuah orbital molekul ? kebanyakan sama atau serupa dengan cara pembentukan ikatan kovalen.
Perbedaannya, bagaimanapun, tiap atom natrium tersentuh oleh delapan atom natrium yang lainnya ? dan terjadi pembagian (sharing) antara atom tengah dan orbital 3s di semua delapan atom yang lain. Dan tiap atom yang delapan ini disentuh oleh delapan atom natrium, yang kesemuanya disentuh oleh delapan atom natrium, terus dan terus sampai kamu memperoleh seluruh atom dalam bongkahan natrium.
Semua orbital 3s dalam semua atom saling tumpang tindih untuk memberikan orbital molekul dalam jumlah yang sangat banyak yang memeperluas keseluruhan tiap bagian logam. Terdapat jumlah orbital molekul yang sangat banyak, tentunya, karena tiap orbital hanya dapat menarik dua elektron.
Elektron dapat bergerak dengan leluasa diantara orbital-orbital molekul tersebut, dan karena itu tiap elektron manjdi terlepas dari atom induknya. Elektron tersebut disebut terdelokalisasi. Logam terikat bersamaan melalui kekuatan dayatarik yang kuat antara inti positif dengan elektron yang terdelokalisasi.
Hal ini kadang-kandang dilukisakan sebagai "susunan inti positif di lautan elektron".
Jika kamu menggunakan tinjauan ini, hati-hati! Apakah logam merupakan atom atau ion? Jawabannya adalah logam merupakan atom.
Setiap pusat positif pada diagram menggambarkan sisa atom yang terlepas dari elektron terluar, tetapi elektron tersebut tidak menghilang – ini mungkin tidak termasuk tambahan pada atom yang istimewa, tetapi pusat positif tetap berada dalam struktur. Karena itu logam natrium ditulis dengan Na – bukan Na+.
Ikatan logam pada magnesium
Jika kamu menyusun argumentasi yang sama dengan magnesium, kamu akhirnya akan memperoleh ikatan yang lebih kuat dan tentunya titik leleh yang lebih tinggi.
Magnesium memiliki struktur elektronik terluar 3s2. Diantara elektro-elektronnya terjadi delokalisasi, karena itu "lautan" yang ada memiliki kerapatan dua kali lipat daripada yang terdapat pada natrium. Sisa "ion" juga memiliki muatan dua kali lipat (jika kamu menggunakan tinjauan ikatan logam) dan tentunya akan terjadi dayatarik yang lebih banyak antara "ion" dan "lautan".
Lebih realistis, tiap atom magnesium memiliki satu proton lebih banyak pada intinya dibandingkan yang dimiliki oleh natrium, dan karena itu tidak hanya akan terdapat jumlah elektron yang terdelokalisasi tetapi juga akan terjadi lebih banyak dayatarik yang terjadi diantara mereka.
Atom-atom magnesium memiliki jari-jari yang sedikit lebih kecil dibandingkan atom-atom natrium dan karena itu elektron yang terdelokalisasi lebih dekat ke inti. Tiap atom magnesium juga memiliki 12 atom terdekat dibandingkan delapan yang dimiliki natrium. Faktor-faktor inilah yang meningkatkan kekuatan ikatan secara lebih lanjut.
Ikatan logam pada unsur-unsur transisi
Logam transisi cenderung memiliki titik leleh dan titik didih yang tinggi. Alasannya adalah logam transisi dapat melibatkan elektron 3d yang ada dalam kondisi delokalisasi seperti elektron pada 4s. Lebih banyak elektron yang dapat kamu libatkan, kecenderungan dayatarik yang lebih kuat akan kamu peroleh.
Ikatan logam pada leburan logam
Pada leburan logam, ikatan logam tetap ada, meskipun susunan strukturnya telah rusak. Ikatan logam tidak sepernuhnya putus sampai logam mendidih. Hal ini berarti bahwa titik didih merupakan penunjuk kekuatan ikatan logam dibandingkan dengan titik leleh. Pada saat meleleh, ikatan menjadi longgar tetapi tidak putus
bagaimana??? sudah jelas belum???kalau belum, ini saya akan menampilkan secara spesifiknya...
Logam atau metal mememiliki beberapa karakter umum yaitu wujud padat, menunjukkan kilap, massa jenis tinggi, titik didih dan titik lebur tinggi, konduktor panas dan listrik yang baik, kuat atau keras namun mudah dibentuk misalnya dapat ditempa (malleable) dan direnggangkan (ductile).
Walaupun demikian terdapat beberapa sifat yang menyimpang misalnya raksa pada suhu kamar merupakan satu-satunya logam yang berwujud padat dan hingga saat ini belum diketahui mengapa raksa berwujud cair. Selain itu titik leleh beberapa unsur logam sangat rendah yaitu Hg, Cs dan Rb dengan titik didih berturut-turut adalah -38,83 °C, 29°C dan 39°C dan Li dan K memiliki massa jenis yang rendah yaitu 0,534 dan 0,86 g/mL.
Emas, perak dan platina disebut logam mulia, sedangkan emas, tembaga dan perak sering disebut sebagai logam mata uang, karena ketiga unsur ini dipadukan untuk membuat koin-koin mata uang. Dikatakan sebagai logam mulia karena ketiga logam ini sukar teroksidasi dengan sejumlah besar pereaksi.
Selain dikenal logam mulia dikenal pula logam berat (heavy metal) adalah logam dengan massa jenis lima atau lebih, dengan nomor atom 22 sampai dengan 92. Raksa, kadmium, kromium dan timbal merupakan beberapa contoh logam berat. Logam-logam berat dalam jumlah yang banyak artinya melebihi kadar maksimum yang ditetapkan, sangat berbahaya bagi kesehatan manusia karena dapat menyebabkan kanker (bersifat karsinogen).
Berdasarkan sifat umum logam dapat disimpulkan bahwa ikatan logam ternyata bukan merupakan ikatan ion maupun ikatan kovalen. Ikatan logam didefinisikan berdasarkan model awan elektron atau lautan elektron yang didefinisikan oleh Drude pada tahun 1900 dan disempunakan oleh Lorents pada tahun 1923.
Berdasarkan teori ini, logam di anggap terdiri dari ion-ion logam berupa bola-bola keras yang tersusun secara teratur, berulang dan disekitar ion-ion logam terdapat awan atau lautan elektron yang dibentuk dari elektron valensi dari logam terkait.
Awan elektron yang terbentuk berasal dari semua atom-atom logam yang ada. Hal ini disebabkan oleh tumpang tindih (ovelap) orbital valensi dari atom-atom logam (orbital valensi = orbital elektron valensi berada). Akibatnya elektron-elektron yang ada pada orbitalnya dapat berpindah ke orbital valensi atom tetangganya. Karena hal inilah elektron-elektron valensi akan terdelokaslisasi pada semua atom yang terdapat pada logam membentuk awan atau lautan elektron yang bersifat mobil atau dapat bergerak.
Dari teori awan atau lautan elektron ikatan logam didefinisikan sebagai gaya tarik antara muatan positif dari ion-ion logam (kation logam) dengan muatan negatif yang terbentuk dari elektron-elektron valensi dari atom-atom logam. Jadi logam yang memiliki elektron valensi lebih banyak akan menghasilkan kation dengan muatan positif yang lebih besar dan awan elektron dengan jumlah elektron yang lebih banyak atau lebih rapat. Hal ini menyebabkan logam memiliki ikatan yang lebih kuat dibanding logam yang tersusun dari atom-atom logam dengan jumlah elektron valensi lebih sedikit.
Misalnya logam magnesium yang memiliki 2 elektron valensi. Berdasarkan model awan elektron, logam aluminium dapat dianggap terdiri dari ion Al2+ yang tersusun secara teratur, berulang dan disekitarnya terdapat awan atau lautan elektron yang dibentuk dari elektron valensi magnesium, seperti pada Gambar.
Gambar Model awan elektron dari lagom magnesium
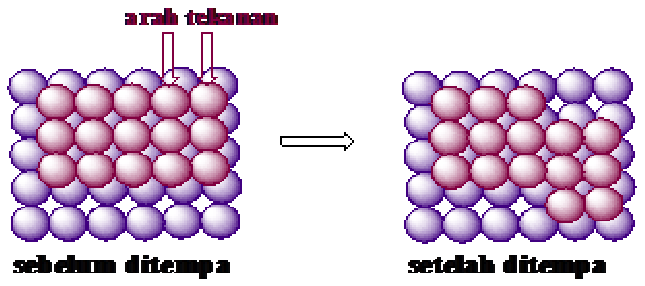
Logam dapat dapat ditempa, direntangkan, tidak rapuh dan dapat dibengkokkan, karena atom-atom logam tersusun secara teratur dan rapat sehingga ketika diberi tekanan atom-atom tersebut dapat tergelincir di atas lapisan atom yang lain seperti yang ditunjukan pada Gambar.
Gambar perpindahan atom pada suatu logam ketika diberi tekanan atau ditempa
Dari gambar menjelaskan mengapa logam dapat ditempa ataupun direntangkan, karena pada logam semua atom sejenis sehingga atom-atom yang bergeser saat diberi tekanan seolah-olah tetap pada kedudukan yang sama.
Keadaan ini berbeda dengan ikatan ionik. Dalam kristal ionik, gaya pengikatnya adalah gaya tarik antar ion yang bermuatan positif dengan ion yang bermuatan negatif. Sehingga ketika kristal ionik diberi tekanan akan terjadi pergeseran ion positif dan negatif yang dapat menyebabkan ion positif berdekatan dengan ion positif dan ion negatif dengan ion negatif. Keadaan ini mengakibatkan terjadi gaya tolak antar ion-ion sejenis sehingga kristal ionik menjadi retak kemudian pecah.
Titik Didih dan Titik Lebur Logam
Titik didih dan titik lebur logam berkaitan langsung dengan kekuatan ikatan logamnya. Titik didih dan titik lebur logam makin tinggi bila ikatan logam yang dimiliki makin kuat. Dalam sistem periodik unsur, pada satu golongan dari atas kebawah, ukuran kation logam dan jari-jari atom logam makin besar.
Hal ini menyebabkan jarak antara pusat kation-kation logam dengan awan elektronnya semakin jauh, sehingga gaya tarik elektrostatik antara kation-kation logam dengan awan elektronnya semakin lemah. Hal ini dapat dilihat pada titik didih dan titik lebur logam alkali.
| Logam | Jari-jari atom logam (pm) | Kation logam | Jari-jari kation logam (pm) | Titik lebur (°C) | Titik didih (°C) |
| Li | 157 | Li+ | 106 | 180 | 1330 |
| Na | 191 | Na+ | 132 | 97,8 | 892 |
| K | 235 | K+ | 165 | 63,7 | 774 |
| Rb | 250 | Rb+ | 175 | 38,9 | 688 |
| Cs | 272 | Cs+ | 188 | 29,7 | 690 |
Daya Hantar Listrik Logam
Sebelum logam diberi beda potensial, elektron valensi yang membentuk awan elektron bergerak ke segala arah dengan jumlah yang sama banyak. Apabila pada logam diberi beda potensial, dengan salah satu ujung logam ditempatkan elektroda positif (anoda) dan pada ujung yang lain ditempatkan ujung negatif (katoda), maka jumlah elektron yang bergerak ke anoda lebih banyak dibandingkan jumlah elektron yang bergerak ke katoda sehingga terjadi hantaran listrik.
Daya Hantar Panas Logam
Berdasarkan model awan elektron, apabila salah satu ujung dari logam dipanaskan maka awan elektron ditempat tersebut mendapat tambahan energi termal. Karena awan elektron bersifat mobil, maka energi termal tersebut dapat ditransmisikan ke bagian-bagian lain dari logam yang memiliki temperatur lebih rendah sehingga bagian tersebut menjadi panas.
Kilap Logam
Permukaan logam yang bersih dan halus akan memberikan kilap atau kilau (luster) tertentu. Kilau logam berbeda dengan kilau unsur nonlogam. Kilau logam dapat dipandang dari segala sudut sedangkan kilau nonlogam hanya dipandang dari sudut tertentu.
Logam akan tampak berkilau apabila sinar tampak mengenai permukaannya. Hal ini disebabkan sinar tampak akan menyebabkan terjadinya eksitasi elektron-elektron bebas pada permukaan logam.
Eksitasi elektron yaitu perpindahan elektron dari keadaan dasar (tingkat energi terendah) menuju ke keadaan yang lebih tinggi (tingkat energi lebih tinggi). Elektron yang tereksitasi dapat kembali ke keadaan dasar dengan memantulkan energi dalam bentuk radiasi elektromagnetik. Energi yang dipancarkan inilah yang menyebabkan logam tampak berkilau.
Aloi atau Alloy
Logam-logam selalu dijumpai dalam kehidupan sehari-hari, misalnya rangka jendela, peralatan-peralatan rumuh tangga, rangka pesawat maupun maupun bahan lain yang menggunakan logam. Bahan-bahan logam tersebut bukan hanya dibuat dari satu jenis unsur logam tetapi telah dicampur atau ditambah dengan unsur-unsur lain yang disebut aloi atau sering disebut lakur atau paduan.
Aloi terbentuk apabila leburan dua atau lebih macam logam dicampur atau leburan suatu logam dicampur dengan unsur-unsur nonlogam dan campuran tersebut tidak saling bereaksi serta masih menunjukan sifat sebagai logam setelah didinginkan.
Aloi dibagi menjadi dua macam yaitu aloi selitan dan aloi substitusi. Disebut aloi selitan bila jari-jari atom unsur yang dipadukan sama atau lebih kecil dari jari-jari atom logam. Sedangkan aloi substitusi terbentuk apabila jari-jari unsur yang dipadukan lebih besar dari jari-jari atom logam.
referensi :
- http://kimia-asyik.blogspot.com/2009/09/ikatan-logam.html
- http://www.chem-is-try.org/materi_kimia/struktur_atom_dan_ikatan/ikatan_kimia/ikatan_logam/
- http://wanibesak.wordpress.com/2011/06/27/ikatan-logam-sifat-sifat-logam-dan-alloy/
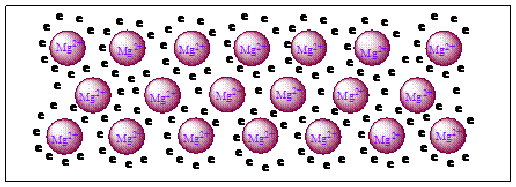
Tidak ada komentar:
Posting Komentar